Daftar Isi di Artikel ini [Tampil]
Kelarutan (Solubility)
A. Pengantar
Halo Sobat, Materi Kelarutan agar mudah dipahami, Kakak harus tau dulu istilah - istilah berikut. Pahami dulu istilah berikut ini ya!:
Larutan :
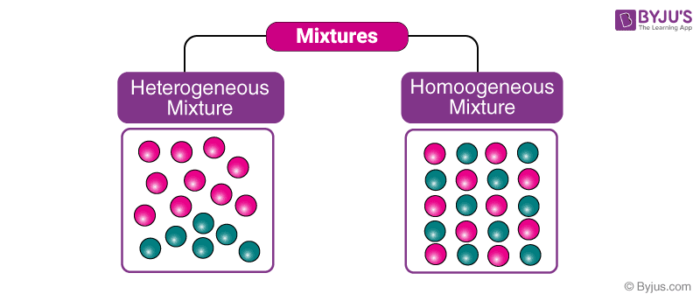
Larutan adalah campuran yang homogen. Dikatakan campuran karena terdiri dari dua atau lebih zat, dan dikatakan homogen karena zat yang bercampur tidak bisa dibedakan . Dengan kata lain. Campuran homogen adalah campuran yang zat penyusunnya tidak dapat dibedakan dan zat penyusunnya terdistribusi secara merata. Oleh karena tidak dapat dibedakan komponen penyusunnya, maka dikatakan sebagai satu fase.
Gambaran submikroskopis kayak gambar dibawah ini nih!.
- Coca Cola : Campuran coca cola didominasi oleh pemanis, gas karbondioksida, dan air yang terdistribusi secara merata dan membentuk satu fase.
- Larutan Gula : Campuran terdiri dari air dan gula dalam satu fasa. Kita tidak bisa membedakan mana air dan mana gula.
- Udara : Udara terdiri dari berbagai gas dan secara fisik seragam.
bukan larutan:
- Pizza yang didalamya terdapat campuran roti, sosis, keju, saos, dll
- sereal dalam susu
- es batu dalam minuman soda
Komponen Penyusun Larutan
Larutan terdiri dari dua komponen, yaitu zat terlarut dan zat pelarut. Zat terlarut (solute) adalah zat yang jumlahnya lebih sedikit di dalam larutan, sedangkan zat pelarut (solvent) adalah zat yang jumlahnya lebih banyak di dalam larutan.
 |
| Source: Pras Academy |
B. Kelarutan (s)
Kelarutan zat dalam air sangat beragam. Ada zat yang mudah larut dan ada pula yang sukar larut. Sebagai patokan, zat dikatakan larut, jika zat tersebut memiliki kelarutan lebih besar dari 0,02 mol setiap 1 Liter.
Pengertian Kelarutan
Bayangkan jika kita menambahkan satu sendok teh kristal garam dapur (Natrium klorida, NaCl) ke dalam segelas air, kemudian diaduk. Apa yang terjadi? Apakah kristal itu larut? apa yang terjadi jika ditambahkan lagi dan ditambah lagi? Apakah garam dapur (NaCl) tadi selalu larut?.Tentu tidak. ada saatnya, larutan tersebut akan menjadi Jenuh dan garam tidak dapat larut lagi.
istilah Kelarutan atau solubility digunakan untuk menyatakan "jumlah maksimum zat yang dapat larut dalam sejumlah tertentu pelarut". atau dengan kata lain jumlah maksimum pelarut dapat melarutkan zat terlarut.
Satuan Kelarutan
Satuan kelarutan dapat dinyatakan dalam gram per 100 gram air dan dapat juga dinyatakan dalam mol / Liter (sama dengan molaritas).
Contoh:
Sebanyak 4,35 mg Ag2CrO4 dapat larut dalam 100 mL air. Nyatakan kelarutan Ag2CrO4 dalam mol per liter. (jika diketahui Ar Cr = 52; Ar O = 16; Ar Ag = 108).
Jawab
(1) menentukan jumlah mol Ag2CrO4
jumlah mol = gram : Mr = 4,35 x 10^-3 gram : 332 gram/mol = 1,31 x 10^-5 mol
(2) kelarutan (s)
s = mol : volume = 1,31 x 10^-5 : 0,1 Liter = 1,31 x 10^-4 mol/Liter.
jadi kelarutan Ag2CrO4 dalam 100 ml Air adalah 0,000131 mol/liter.
Sifat kelarutan zat
Berdasarkan sifat kelarutannya kondisi garam dibedakan menjadi tiga kondisi, yaitu sebagai berikut.
- Kondisi tidak jenuh (unsaturated), artinya kondisi saat konsentrasi nyata suatu garam belum melampaui kelarutannya, sehingga masih bisa larut.
- Kondisi tepat jenuh (saturated), artinya kondisi saat konsentrasi nyata suatu garam sama dengan kelarutannya, sehingga zat tepat mengendap.
- Kondisi lewat jenuh (supersaturated), artinya kondisi saat konsentrasi nyata garam melampaui kelarutannya, sehingga zat yang mengendap lebih banyak daripada yang larut.
Perhatikan video berikut untuk membedakan larutan tidak jenuh, jenuh, dan lewat jenuh.
bagaimana sudah paham kan? atau kalian sedang jenuh mempelajari kimia, atau lewat jenuh karena dia? :P😬
C. Tetapan Hasil Kali Kelarutan (Ksp)
Ksp bukan singkatan dari Koperasi SImpan Pinjam lo ya!. Ksp (solubility product constant) merupakan tetapan kesetimbangan untuk zat yang sukar larut.
Misalnya perak kromat Ag2CrO4 yang merupakan contoh garam sukar larut dalam air. jadi jika kita masukkan sedikit saja kristal garam itu ke dalam air, kemudian diaduk, maka kita akan melihat bahwa sebagian besar dari garam itu tidak larut (mengendap di dasar wadah). Kondisi itu termasuk dalam kondisi lewat jenuh. Kondisi lewat jenuh dapat terjadi saat kondisi jenuh masih ditambahkan zat terlarut lagi, sehingga pelarut dalam hal ini air tidak mampu melarutkan lebih banyak zat terlarut lagi.
Nah! apakah proses melarutkan berhenti pada keadaan tersebut. Jawabannya adalah tidak. Melalui percobaan diketahui bahwa dalam larutan jenuh tetap terjadi proses melarut, tetapi pada saat yang bersamaan terjadi proses pengkristalan (endapan) dengan laju yang sama.
Gambarannya kayak gni nih! tapi pakai garam perak klorida AgCl. Konsepnya sama dengan perak kromat, tinggal ion Cl- diganti dengan ion CrO42-
Laju pelarutan = laju pengkristalan.
persamaan reaksinya : Ag2CrO4 (S) <=> 2Ag+(aq) + CrO42-(aq)
keterangan: (s) = padat; (aq) = larutan
Dari persamaan reaksi di atas maka nilai Ksp nya adalah
Ag2CrO4 (S) <=> 2Ag+(aq) + CrO42-(aq)
KSP = [Ag+]^2 [CrO42-]
atau biar lebih jelas
.jpg)
.jpg=w74-h74-p-k-no-nu)


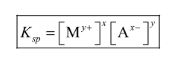

Silahkan beri komentarnya